 |
漢方薬によるがん転移阻害のメカニズム |
和漢医薬学総合研究所 済木育夫 教授
Contents
- 十全大補湯および関連方剤
- 十全大補湯の経口投与による癌の悪性化進展 (プログレッション) の抑制
- 十全大補湯による癌転移の抑制効果とその作用機序
- 十全大補湯関連方剤の経口投与による癌転移の抑制効果と構成生薬の組合せ
- 漢方方剤のハーモナイゼーション効果
- 漢方方剤の効果発現は臓器選択性 (反応の場) あるいは体質 (系統差) が関係しているか?
- 現行の治療と漢方方剤との併用による転移抑制効果の増強
- 関連文献
十全大補湯および関連方剤
癌治療において、漢方薬の守備範囲は、実際には通常の標準治療における副作用の防止、体力回復、効果の増強、日和見感染の防止などの多くの報告がある。また、癌細胞への直接的な攻撃を必要としない場合に、術後の体力回復、再発・転移の予防、癌体質の改善などにも適用されうる。末期の癌患者で、西洋医学ではもはや望みがないというときに使われ、生活の質 (QOL) の改善、あるいは癌との共存を求めて漢方薬により生存期間の延長、生体防御の強化、治癒力の活性化を図るというところで使用されるのではないかと考えられる。その目的のために使われる漢方薬としては、基本的には体力回復や生体防御の強化のための補剤、あるいは微小循環障害とそれに伴う病態変化として定義されている瘀血を改善する駆瘀血剤、あるいは水のバランスを調節する利水剤、生体の諸機能の調節をする和剤、あるいは癌患者の抑うつ状態、ストレス等の精神的要因を改善する理気剤などである。
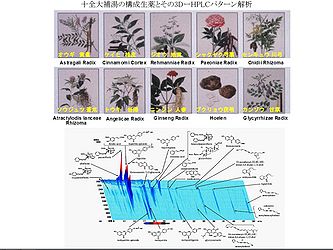
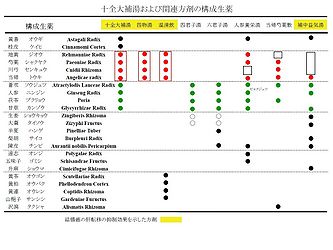
十全大補湯は、『大平恵民和剤局方』に1151年に初めて収載された処方であり、10種類の生薬を配合した漢方方剤である [1, 2]。川弓、当帰、地黄、芍薬で構成される四物湯と蒼朮、人参、茯苓、甘草を含む四君子湯に、黄耆と桂皮を加えて、気・血・陰・陽のバランスをとるように配合され (図1)、古くから病後、術後あるいは慢性疾患などで全身倦怠感が著しく、顔色不良で食欲不振の傾向がある場合に有効とされてきた。また、その関連方剤として、人参養栄湯、補中益気湯、四物湯及び四君子湯などの方剤とその構成生薬を図2に示す。方剤の構成生薬について、採取した時期、原植物の由来や使用部位、調製方法あるいは煎じ方などの違いにより、含まれる成分やそれに基づく効果あるいは活性発現に違いが出てくることが考えられる。実際に、十全大補湯の構成生薬の一つを類似関連生薬で置換した変異処方 (たとえば、蒼朮→白朮あるいは大和当帰→北海当帰に置換) では後述の癌の転移抑制効果が減弱することを明らかにしてきた [3]。したがって、できるだけ一定の効果を得るため、漢方方剤のHPLCパターン分析 [3]、すなわちfingerprint解析をしてbatchなどを確認することにより (図1)、常に一致あるいは類似したパターンの方剤を用いることが望まれる。
十全大補湯の経口投与による癌の悪性化進展 (プログレッション) の抑制
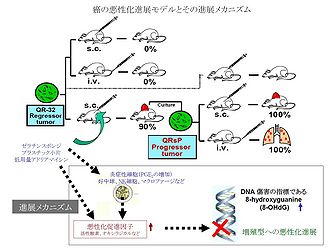
C57BL/6マウス線維肉腫より分離したQR-32退縮型癌細胞が、正常同系マウスに皮下あるいは静脈内移植すると自然退縮して生着しないが、異物であるゼラチンスポンジ、プラスチック小片などの異物あるいは低用量の制癌剤と同時に皮下移植することにより、致死的増殖性を獲得した癌細胞に不可逆的に変換する実験モデル (図3) を用いて、十全大補湯の経口投与により増殖型への悪性化変換が阻止された [4]。悪性化進展を促進する因子として宿主反応細胞が注目されるが、この宿主反応細胞から放出されるオキシラジカルやサイトカイン・増殖因子が関与していることが推察される。いくつかの生薬あるいは漢方方剤にラジカルスカベンジャー作用があることが報告されており、十全大補湯の構成成分である桂皮にも強力なラジカルスカベンジャー作用があることも明らかになっている。実際、ビタミンC、次硝酸ビスマス (メタロチオネインを誘導) 、好中球に対する抗体、10Gyの放射線照射 (炎症性細胞の破壊) 、PSKの投与 (Mn-SODやGPxの誘導) により、悪性化変換が抑制されることが証明されている。したがって、悪性化進展に及ぼす十全大補湯の作用機序のひとつとして、腫瘍組織へのラジカルスカベンジャーの誘導が推察される。
十全大補湯による癌転移の抑制効果とその作用機序
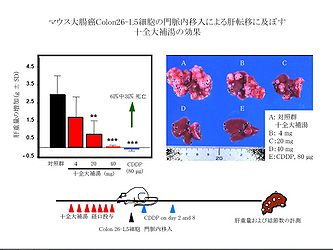
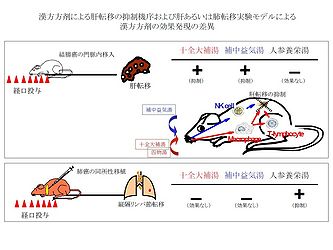
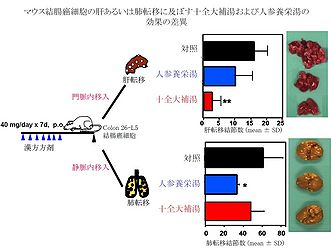
十全大補湯をcolon 26-L5結腸癌細胞の接種前の7日間、経口投与した群は、用量依存的に顕著に癌細胞の肝転移 (肝重量および結節数の増加) を抑制した (図4) [5, 6, 12]。さらに十全大補湯 (40 mg/day) を投与した群では病理組織学的に微小転移もほとんど認められず、有意な生存期間の延長が観察された。陽性対照のシスプラチン(CDDP)投与群は効果が認められたものの著しい体重の減少を伴い、50%のマウスが死亡するという重篤な副作用を示したのに対して、十全大補湯投与群では、そのような副作用は全く認められなかった [5]。このことから、転移の予防あるいは防止に十全大補湯を長期間投与することが可能であると考えられる。
生体防御機構をつかさどる免疫担当細胞のなかで、特に抗腫瘍作用に関わる代表的なNK細胞、マクロファージ、T細胞を、それぞれ除去あるいは欠損したマウスを用いて十全大補湯の転移抑制効果を検討した結果、十全大補湯の経口投与による肝転移の抑制効果の機序として、NK細胞が介在した様式ではなく、マクロファージおよびT細胞が関与して抗転移効果を発揮することが明かとなった (図5) [5, 6, 12]。さらに、経口投与された十全大補湯は、マクロファージ上のToll-like receptor 4 (TLR4) 自身の発現の増強には影響しないが、それを介してLPS誘導性のIL-12 p40およびIFN-γのサイトカイン産生を増強した [7]。十全大補湯はTLR4の下流のシグナル伝達経路であるNF-κB p65、p38 MAPKのリン酸化の増強を認めたが、JNK、ERKのリン酸化に関しては減弱を示した [7]。このように多成分系の漢方方剤を用いた分子レベルでの効果発現メカニズムも明らかにされつつある。
十全大補湯関連方剤の経口投与による癌転移の抑制効果と構成生薬の組合せ
十全大補湯は、四物湯と四君子湯に黄耆と桂皮を加えた処方であることから、四物湯と四君子湯について転移抑制効果を検討した結果 (効果のある方剤は表中に黄色で網掛け) 、四物湯 (図2中の四つの●で示した生薬を含む) は有意な抑制効果を示したが、四君子湯 (図2中の四つの●で示した生薬を含む) では全く効果が認められなかった [1, 2, 6]。さらに、関連処方として、四物湯と黄連解毒湯の合剤である温清飲も転移抑制効果を示したことから、十全大補湯の転移抑制効果の発現には、補血作用 (血虚を改善する作用) を有する四物湯の処方が活性発現に重要な働きをしていることが示唆された。
さらに、人参養栄湯及び当帰芍薬散は転移抑制効果が認められなかった。人参養栄湯は、効果を示さなかった四君子湯処方に加え、四物湯の処方の中で川弓を欠いた構成生薬を含んでいること、当帰芍薬散は四物湯の処方の中で地黄を欠いた構成生薬を含んでいることから、抑制効果が認められないと推察される。そのことは川弓及び地黄が効果の発現に重要な役割を演じている可能性が考えられる。
一方、四物湯の処方を含まない補中益気湯も明らかな転移を抑制する効果を示した (図2) [1, 2]。上述のごとく同様に、免疫担当細胞を除去あるいは欠損したマウスを用いて検討した結果、補中益気湯による転移抑制効果は、興味深いことに、十全大補湯の場合と逆の抑制機序、すなわち主としてNK細胞を介した経路が関与していることが示された (図5) [1, 2]。このように多成分系の漢方方剤 (たとえば十全大補湯および補中益気湯) が異なった作用メカニズムを示すことが明らにされることにより、漢方薬による分子標的治療や漢方薬同士あるいは西洋薬との併用治療も可能であると推察される。また、従来から指摘されているように、漢方方剤の効果発現にどの単一有効成分が、どの組み合わせの処方が関わっているかなどをさらに詳細に明らかにするための分析・解析手法を確立することも、複雑系の漢方方剤を扱う上で重要な今後の課題と思われる。
漢方方剤のハーモナイゼーション効果
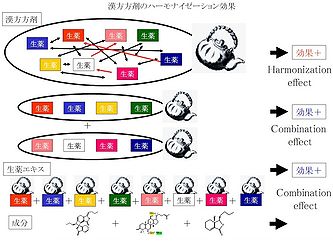
十全大補湯の転移抑制効果は、四君子湯というより四物湯の抑制効果に依存しているが (図2) [1, 2, 6]、四物湯単独の効果は、有意差はあるものの、十全大補湯に比較して明らかに減弱している。四君子湯単独では効果を示さないが、現代医学的に両方剤を併用、すなわち四物湯と四君子湯を一緒に投与した結果、四物湯単独の効果以上の成果が得られない。すなわち、それぞれの漢方薬を併用 (combination) するのではなく、十全大補湯のように最初から2つの処方を一緒にし、調整の段階から煎じることが、より効果を発揮することを意味している。これは、処方中の構成生薬、各生薬に含まれている多くの成分が、煎じている段階で相互に作用あるいは反応した結果、総合的な効果を発揮すると考えられる。したがって、漢方薬の効果は、単なる生薬やそのエキスの総和 (足し算) としての併用 (combination) 効果ではなく、複合生薬あるいは成分の調和 (harmonization) 効果であると考えられる (図6)。
漢方方剤の効果発現は臓器選択性 (反応の場) あるいは体質 (系統差) が関係しているか?
十全大補湯は、すでに述べたように、BALB/cマウスを用いた結腸癌の肝転移モデル系では有効性を示したが、C57BL/6マウスにルイス肺癌を肺に同所性移植することによる縦隔リンパ節転移の実験系では補中益気湯と同様にほとんど効果が認められなかった (図5)。一方、結腸癌の肝転移系で効果がみられなかった人参養栄湯及び当帰芍薬散は、このリンパ節転移モデルにおいて効果のない十全大補湯とは逆に転移抑制効果を示した (図5) [1, 2, 8]。この結果の違いとして、用いたマウスの系統差すなわち体質 (constitution, あるいはresponder/non-responder) の差における漢方薬の効果の違いが考えられるか、あるいは癌細胞の転移する臓器 (肝あるいは肺) での環境等の因子の差異などに基づく可能性などが示唆される。たとえばBALB/cおよびC57BL/6マウスは、Th1およびTh2細胞由来サイトカイン (IFN-γあるいはIL-4) がそれぞれ優位に発現していることがよく知られていることから、漢方薬の効果とTh1およびTh2バランスとの関連性も一つの可能性かもしれない。
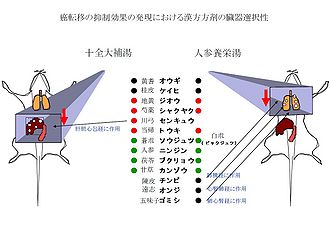
同一の結腸癌細胞を同系マウスの門脈内移入あるいは尾静脈内移入により形成される肝転移および肺転移に対して、十全大補湯および人参養栄湯の抑制効果が明らかに異なり、十全大補湯は肝転移に対して有意に抑制したが、肺転移には抑制効果を示さなかった (図7) [8]。これに対して、人参養栄湯は逆の効果、すなわち肝転移には効果を示さなかったが、肺転移に対して有意な抑制を示した (図7) [1, 2, 8]。このように、二つの方剤の臓器選択的な転移抑制効果が観察された解釈として、興味あることに、13世紀に確立された中医学の経絡論theory of Jing and Lun (引経報使) の考えに、部分的に通ずるものがあるかもしれない。十全大補湯は肝胆経に、あるいは人参養栄湯は肺経に作用する生薬 (それぞれ川弓あるいは五味子、陳皮、遠志) を含んでいることが病態の改善と関係していると推察される (図8)。
現行の治療と漢方方剤との併用による転移抑制効果の増強
ヒト腎細胞癌に対してインターフェロン治療が行われているにもかかわらず、奏功率が低いため、より有効な治療法の開発が望まれている。マウス腎細胞癌の肺転移モデルを用いて、十全大補湯とインターフェロン¬-αA/Dの併用効果を検討した結果、明らかに各単独投与群と比較して有意な肺への転移抑制効果の増強とインターフェロンによる副作用の軽減が認められた [1, 2, 9]。黄連や黄柏の主成分であるベルベリンは止瀉、抗炎症、抗コレステロ−ル作用などを有するとともに、 その経口投与によりルイス肺癌の同所性移植による縦隔リンパ節転移を抑制し、さらに塩酸イリノテカンCPT-11との併用により移植部位の腫瘍増殖ならびにリンパ節転移を相乗的に抑制した [10]。また、CPT-11が引き起こす遅延性の下痢に対してベルベリンの止瀉効果が期待できるかもしれない。リンパ節転移の抑制機序として、転移関連分子の発現や増殖の制御に関わる転写因子AP-1の活性抑制作用が関与している [10]。鬱金の主成分であるクルクミンとシスプラチンとの併用により、単独投与に比較して強い抑制効果が認められた [11]。薬用人参のサポニン成分はメラノ−マ細胞の肺転移抑制効果を示し、その効果発現は腸内細菌代謝産物によるアポトーシスの誘導、細胞周期関連分子の制御 (cyclin D ↓, c-Myc↓, p27Kip1↑) 、癌細胞の浸潤抑制、血管新生阻害などに基づくことも明らかにした [12, 13, 14]。
関連文献
- Saiki I.: Review: A Kampo medicine “Juzen-taiho-to” –Prevention of malignant progression and metastasis of tumor cells and the mechanism of action–. Biol. Pharm. Bull., 23: 677-688, 2000.
- Yamada H. and Saiki I. (eds.) Traditional herbal Medicines for Modern Times Volume 5, “Juzen-taiho-to (Shi-Quan-Da-Bu-Tang)” Scientific Evaluation and Clinical Applications, CRC Press Taylor & Francis Group, Boca Raton FL, 2005, pp1-242
- Saiki I., Yamaura T., Ohnishi Y., Hayakawa Y., Komatsu Y. and Nunome S.: HPLC analysis of Juzen-taiho-to and its variant formulations and their antimetastatic efficacies. Chem. Pharm. Bull., 47: 1170-1174, 1999.
- Ohnishi Y., Fujii H., Kimura F. Mishima T., Murata J., Tazawa K., Fujimaki M., Okada F., Hosokawa M. and Saiki I: Inhibitory effect of a traditional Chinese medicine, Juzen-taiho-to, on progressive growth of weakly malignant clone cells derived from murine fibrosarcoma. Jpn. J. Cancer Res., 87: 1039-1044, 1996.
- Ohnishi Y., Fujii H., Hayakawa Y., Sakukawa R., Yamaura T., Nunome S., Komatsu Y. and Saiki I: Oral administration of a Kampo (Japanese herbal) medicine Juzen-taiho-to inhibits liver metastasis of colon 26-L5 carcinoma cells. Jpn.. J. Cancer Res., 89: 206-213, 1998.
- Ohnishi Y., Yamaura T., Tauchi K., Sakamoto T., Tsukada K., Nunome S., Komatsu Y. and Saiki I: Expression of the anti-metastatic effect induced by Juzen-taiho-to is based on the content of Shimotsu-to constituents. Biol. Pharm. Bull., 21: 761-765, 1998.
- Chino A, Sakurai H., Matsuo M., Choo M-K., Koizumi K., Shimada Y., Terasawa K. and Saiki I.: Juzentaihoto, a Kampo medicine, enhances IL-12 production by modulating Toll-like receptor 4 signaling pathways in murine peritoneal exudate macrophages. Int. Immunopharmacol., 5: 871-882, 2005.
- Matsuo M., Tani T. and Saiki I.: Organ selectivity of Juzen-taiho-to and Ninjin-yoei-to in the expression of anti-metastatic efficacy. J. Trad. Med., 19: 93-97, 2002.
- Muraishi Y., Mitani N., Yamaura T., Fuse H. and Saiki I.: Effect of interferon-α A/D in combination with the Japanese and Chinese traditional herbal medicine Juzen-taiho-to on lung metastasis of murine renal cell carcinoma. Anticancer Res., 20: 2931-2938, 2000.
- Mitani N., Murakami K., Yamaura T., Ikeda T. and Saiki I.: Inhibitory effect of berberine on the mediastinal lymph node metastasis produced by orthotopic implantation of Lewis lung carcinoma. Cancer Lett., 165: 35-42, 2001.
- Ichiki K., Mitani N., Doki Y., Hara H., Misaki T. and Saiki I.: Regulation of activator protein-1 activity in the mediastinal lymph node metastasis of lung cancer. Clin. Exp. Metastasis, 18, 539-545, 2001.
- Wakabayashi C., Hasegawa H., Murata J.and Saiki I.: In vivo antimetastatic action of ginseng protopanaxadiol saponins is based on their intestinal bacterial metabolites after oral administration. Oncol. Res, 9: 411-417, 1997.
- Wakabayashi C., Murakami K., Hasegawa H., Murata J. and Saiki I.: An intestinal bacterial metabolite of ginseng protopanaxadiol saponins has the ability to induce apoptosis in tumor cells. Biochem. Biophys. Res. Commun., 246: 725-730, 1998.
- Hasegawa H. and Saiki I (eds.), “Cancer prevention by Ginseng via its intestinal bacterial metabolites”, published by Art Village, Tokyo, 2003, pp 1-149.