悪性黒色腫の免疫抵抗性と転移能の獲得に細胞内解毒酵素が重要であることを発見
■ ポイント
- 悪性黒色腫の治療成績は分子標的薬や免疫チェックポイント阻害薬(ICBs)の開発によって大きく改善しているが、一方で治療抵抗性や転移能の獲得など悪性化進展の克服が依然として課題である。
- 細胞内解毒酵素の一種であり、酸化ストレス応答に関わる分子であるグルタチオン-S-トランスフェラーゼ A4(GSTA4)が、悪性黒色腫の免疫応答に対する抵抗性と遠隔臓器への転移能を獲得するために重要であることを明らかにした。
- GSTA4をターゲットとすることで、がん免疫療法に抵抗性を示すがん細胞や転移性がん細胞に対する新たな治療法の開発が期待できる。
■ 概要
本研究所の早川芳弘教授、学術研究部薬学・和漢系の横山悟准教授、同工学系の髙崎一朗准教授らの研究グループは、細胞内解毒酵素の一種であり、酸化ストレス応答に関わる分子であるグルタチオン-S-トランスフェラーゼ A4(GSTA4)が悪性黒色腫の免疫応答に対する抵抗性と遠隔臓器への転移能を獲得するために重要であることを明らかにしました。さらにGSTA4を抑制することで悪性黒色腫の免疫抵抗性や転移能が減弱することを明らかにしました。
今回発表する成果は、臨床で依然として大きな課題である治療抵抗性や転移能の獲得など、がん細胞の悪性化進展に対する新たな治療法の提案へとつながる可能性があり、今後研究を進めていくことで、現在広く悪性黒色腫をはじめとしたがんの治療に用いられているICBsの有効性をさらに高める方法の開発も期待されます。
この研究成果は、2022年9月27日付けで米国科学雑誌「Molecular Cancer Research」にオンライン公開されました。また本研究は、日本学術振興会科学研究費助成事業(17H06398, 21H02783)、安田記念医学財団の支援を受けて行われました。
■研究の背景
一般的にがん細胞は正常細胞と比べて可塑性が高く、不均一な細胞集団であるため、化学療法剤や分子標的治療薬、放射線療法などの治療に対してがん細胞が抵抗性を獲得することや、転移能の獲得による悪性化進展が見られます。一方、がんの発症の過程において、生体防御機構である免疫応答による監視(免疫監視)を回避する能力を有するがん細胞の選択が起きる事は、「がん免疫エディティング」の概念として広く知られていますが、この過程においてもがん細胞自身が抗腫瘍免疫応答に対して抵抗性(耐性、不応答性)を獲得することが推察されてきました。実際にこれまでの研究から、がん抗原特異的な免疫応答対して、がん細胞はがん抗原そのものや、抗原提示分子(MHC)の発現低下、宿主免疫T細胞の疲弊や抑制性免疫細胞の誘導など、様々な要因によって免疫監視から逃避することが指摘されています。しかしながら、がん細胞がどのような分子メカニズムによって免疫応答からの排除に対して抵抗性を獲得するのか、その詳細については明らかでなく重要な研究課題でした。
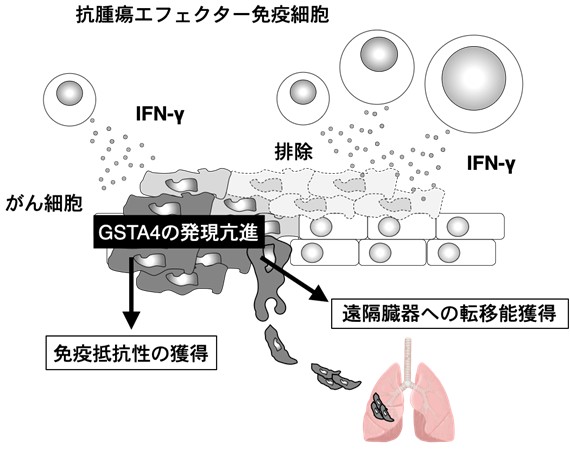
そこで私たちの研究グループは、免疫監視に対して抵抗性を獲得した悪性黒色腫細胞の遺伝子発現解析を行い、その結果から細胞内の酸化ストレス応答に関わる分子であるグルタチオン-S-トランスフェラーゼ A4(GSTA4)の過剰発現が、悪性黒色腫の免疫応答に対する抵抗性と遠隔臓器への転移能を獲得するために重要であることを明らかにしました。
■研究の内容・成果
マウスの悪性黒色腫モデルを用いて、抗腫瘍免疫応答に抵抗性を獲得したがん細胞を取得し、これらの遺伝子発現解析によってその特徴を調べました。特に免疫応答によるがん細胞の攻撃に重要なエフェクター分子であるインターフェロン-ガンマ(IFN-g)に対して抵抗性を獲得したがん細胞において、最も発現が上昇した遺伝子として細胞内の酸化ストレス応答に関わる分子であるグルタチオン-S-トランスフェラーゼ A4(GSTA4)を見出しました。さらに、悪性黒色腫細胞におけるGSTA4の過剰発現とIFN-g応答抵抗性の関係を明らかにする目的で、人為的にGSTA4の発現を抑制した細胞、または過剰発現させた細胞を作成した結果、GSTA4の発現上昇が悪性黒色腫細胞の免疫応答に対する抵抗性の獲得に必須であることを見出しました。GSTA4を高発現する免疫抵抗性の悪性黒色腫細胞は、マウスを用いた実験モデルにおいてICBsである抗PD-1抗体による治療やがんワクチン療法に対して不応答でしたが、GSTA4の発現を抑制することで、それらの治療効果が認められるようになりました。さらに免疫抵抗生を獲得したGSTA4高発現する悪性黒色腫細胞は、発現の低い細胞と比較して試験管内、または動物実験モデルの両方において高い転移能を示しました。このような遠隔臓器への転移能の上昇についても、GSTA4の発現上昇と相関していました。
■今後の展開
本研究では、悪性黒色腫の免疫応答に対する抵抗性と遠隔臓器への転移能を獲得するために重要であることを明らかにしました。現在、我々の研究グループではさらにGSTA4をターゲットとした新たな治療法の開発や、他のがん腫における免疫抵抗性に関わるメカニズムの理解について探索を進めているところです。今後の研究で、がん細胞の免疫応答に対する抵抗性獲得や転移能獲得に関わる機序の理解がさらに進むと考えられ、これによってより多くの患者さんがICBsをはじめとするがん免疫療法の恩恵を受けることが出来るようになることが期待されます。
【用語解説】
・がん免疫エディティング:
免疫系は自己と非自己を識別し、非自己を排除する生体防御システムですが、自己の変異細胞であるがん細胞も排除して生体を防御するという「がん免疫監視機構」が存在する。一方、がん免疫監視機構が存在するにもかかわらず、がん細胞は増殖し病態としてのがんが成立するため、この過程を説明する概念が「がん免疫エディティング」である。自己の変異細胞であるがん細胞は免疫原性が高いため、免疫細胞は異物だと判断して攻撃し排除するが、免疫原性の低いがん細胞や、免疫細胞の機能を抑制する「免疫チェックポイント分子」を発現する細胞は免疫担当細胞からの監視から逃避して増殖することで悪性化し、病態としてのがんが成立しているという考え方。
・免疫チェックポイント阻害剤(ICBs):
免疫チェックポイント阻害薬は、前述の免疫チェックポイント分子もしくはそのリガンド分子に結合して免疫抑制シグナルの伝達を阻害することで、がん細胞を攻撃する免疫細胞に対するブレーキを解除する薬剤。抗PD-1抗体や抗PD-L1抗体などがあり、様々ながん腫に対する治療に用いられる。
・グルタチオン-S-トランスフェラーゼ A4(GSTA4):
グルタチオン-S-トランスフェラーゼは生物に広く存在する代謝酵素であり、生体内の生合成や薬物などの代謝分解において重要な役割を持つ分子であり、GSTA4は特に生体内で生じる過酸化脂質の代謝に関わる酵素であり、細胞の酸化ストレス応答の制御に重要である。がん細胞においては抗がん剤に対する耐性の獲得にGSTA4分子が関わることが知られている。
・インターフェロン-ガンマ(IFN-g):
抗腫瘍エフェクター免疫細胞であるナチュラルキラー(NK)細胞や細胞傷害性(CD8)T細胞が主に産生するサイトカイン。特異的受容体を介してがん細胞に対してシグナルを伝達し、免疫細胞による認識を上昇させたり、がん細胞に増殖抑制や細胞死を誘導する。
【論文詳細】
論文名:
GSTA4 governs melanoma immune resistance and metastasis
著者:
Sisca Ucche, Satoru Yokoyama, Marija Mojic, Kohei Oki, Chikako Ohshima, Haruka Tsuihiji, Ichiro Takasaki, Hideaki Tahara, Yoshihiro Hayakawa
掲載誌:
Molecular Cancer Research,
2022.09.27 研究成果









