転写因子SOX10が悪性黒色腫の免疫原性を調節していることを明らかにし、その治療応用への可能性を証明
■ ポイント
- ノーベル医学生理学賞を受賞した本庶佑先生らの研究により開発された「免疫チェックポイント阻害薬(ICBs)」は画期的ながん治療薬であるが、効果が得られない患者が一定数存在するという問題がある。
- 効果的ながん免疫療法にはがん細胞の免疫応答性(免疫原性)が重要であるが、今回の研究成果から悪性黒色腫の免疫原性を調節している新規メカニズムを明らかにした。
- 今回の研究成果は、ICBsに対して応答性の低いがん患者に対する“より有効な”がん免疫療法の開発へと結びつくことが期待される。
■ 概要
富山大学学術研究部薬学・和漢系、がん細胞生物学の横山 悟 准教授と本研究所・生体防御学の早川 芳弘 教授の研究グループは、名古屋大学医学部、マサチューセッツ総合病院、ダナファーバー癌研究所、イリノイ大学との国際共同研究により、皮膚癌の一種である悪性黒色腫において転写因子SOX10が、がん細胞の免疫原性を調節していることを明らかにしました。SOX10を抑制することでこれまでに知られていたJAKを介した経路でなく、IRF4を介した経路で免疫原性を調節する重要な分子であるIRF1が誘導されること、さらにSOX10を抑制する薬剤を用いてIRF1を活性化することで悪性黒色腫に対する免疫チェックポイント阻害剤(ICBs)の効果が増強できることを発見しました。
今回発表する成果は、これまでICBsを始めとするがん免疫療法が有効でないとされていた患者に対する新たな治療法の開発につながることが期待できます。
この研究成果は、2021年11月2日(日本時間23時)にCancer Researchにオンライン公開されました。
■ 研究の背景
抗PD-1抗体を代表とする免疫チェックポイント阻害剤(ICBs)は、適応のあるがん腫に対して約3割程度の患者に対して高い治療効果が得られるのに対して、その他の患者では有効性が見られないこと、さらに治療効果が見られる患者においても抵抗性を獲得することが大きな問題となっています。その理由としてこれまでの研究から、腫瘍組織内の環境(腫瘍微小環境)やがん細胞の特性、特に抗腫瘍性サイトカインであるインターフェロン-ガンマ(IFN-γ)への応答性がICBsへの応答性と関連することが明らかになってきました。具体的にはICBsへの不応答性の機序として、IFN-γシグナルの下流に存在するJAK1/2変異が報告されており、さらにその下流分子であるIRF1の活性化が適切に起こらないことによって、がん細胞の免疫細胞に対する応答性が低下していることが挙げられます。この問題を解決するために、免疫応答性が低いがん細胞においてJAK1/2を介さずにIRF1の活性化を引き起こすことのできるバイパス経路の存在の有無は非常に重要な課題です。
■ 研究の内容・成果
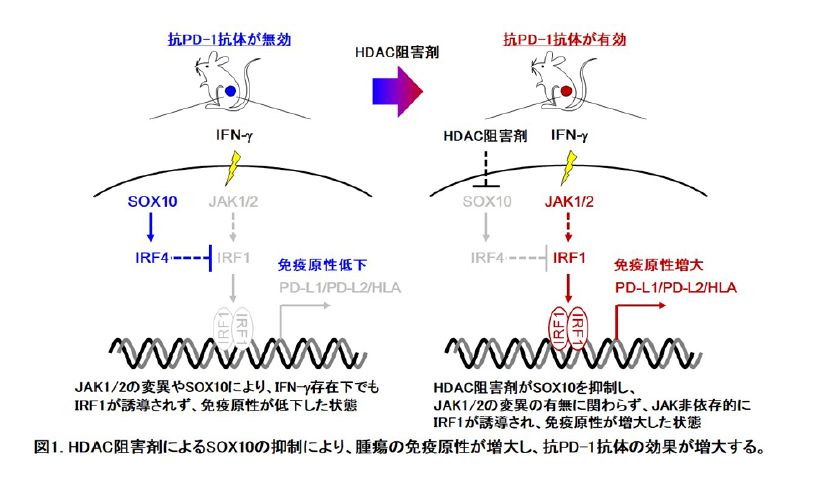
以上の背景から、今回私たちの研究グループでは、がん細胞内でIRF1発現を抑制する新規経路を明らかにすることが、この問題の解決に結びつくのではないかと仮説を立て研究を行いました。まず公開されている悪性黒色腫の遺伝子発現解析のデータを再解析することで、IRF1によってその発現が制御されているPD-L1遺伝子の発現と逆相関する遺伝子を探索し、その候補として転写因子SOX10を同定しました。次に、実際にSOX10によってPD-L1の発現が制御できるかについて、SOX10の発現を抑制するsiRNAを悪性黒色腫に導入して評価した結果、SOX10を抑制した悪性黒色腫ではPD-L1の発現が誘導できることが明らかになりました。同時にSOX10を抑制した悪性黒色腫ではIRF1の発現誘導、さらにPD-L1以外のIRF1下流遺伝子であるHLAやPD-L2の発現誘導も観察されました。また、SOX10抑制によるIRF1やPD-L1の誘導はJAK阻害剤によって影響を受けなかったことから、この経路はJAK1/2を経由しないこと、さらにIRF1の抑制因子として知られるIRF4の発現低下が見られたことから、これまでに知られていない新しいバイパス経路を介していることが示唆されました。つまりSOX10はJAK非依存的にIRF4を介してIRF1を抑制することで、がん細胞の免疫原性を低下させる機能を持つことを明らかにしました。
これらの結果をさらに治療へと応用するために、我々が以前にSOX10を抑制する薬剤として見出したヒストン脱アセチル化酵素阻害剤のボリノスタットが、がん細胞の免疫原性を回復できないか評価しました。その結果、ボリノスタットは悪性黒色腫のSOX10の抑制を介してIRF1やPD-L1の発現を誘導しました。さらに、ボリノスタットによるSOX10の抑制を介したIRF1経路の活性化が、より有効ながん免疫療法に結びつくのか、マウス腫瘍移植モデルで評価した結果、ICBsである抗PD-1抗体の治療に応答性の低い悪性黒色腫に対して、ボリノスタットを併用することでる抗PD-1抗体の抗腫瘍効果が増強できることを明らかにしました(図1)。
■ 今後の展開
本研究の成果から、悪性黒色腫ではヒストン脱アセチル化酵素阻害剤によりSOX10を抑制することで、JAK非依存的にIRF4を介してIRF1が誘導され、がん細胞の免疫原性を亢進し、抗PD-1抗体の効果が増強できることを示しました。現在、我々の研究グループではヒストン脱アセチル化酵素阻害剤以外でSOX10-IRF4経路を介してIRF1を誘導することができる薬剤の探索を進めています。また、本研究で見出したSOX10を介したIRF1の調節機能は、現在のところ悪性黒色腫以外のがん腫で同様の機能が認められるかは不明です。将来的には、悪性黒色腫に限らずその他多くのがん腫において、JAKを介さずにIRF1発現を調節するバイパス経路が明らかにされ、さらにはそれを制御する薬剤が開発されることによって、抗PD-1抗体を始めとするがん免疫療法に対して応答性の低い患者に対して有効な治療を提供できるようになることも期待できます。
■ 用語解説
腫瘍免疫原性
腫瘍細胞が免疫細胞に認識される度合い。遺伝子変異が多く、腫瘍特異的抗原を提示しているような腫瘍細胞は、免疫細胞に認識され、攻撃されやすい。一方、腫瘍細胞は自身の免疫原性を低下させ、免疫からの逃避する仕組みを持つ。
siRNA
small interfering RNAの略。21-23塩基対から成る低分子二本鎖RNAである。細胞内で相補的な配列を持つメッセンジャーRNAを選択的に分解する。標的遺伝子の発現量が低下することから、その遺伝子の機能を予測するために用いる実験材料である。
免疫チェックポイント阻害剤(ICBs)
がん細胞を攻撃する免疫細胞に対してブレーキ役として働く免疫チェックポイント分子を阻害する薬剤。京都大学の本庶佑先生が免疫チェックポイント分子の一つであるPD-1を発見し、ノーベル医学生理学賞を受賞した。ヒトの免疫細胞を再活性化し、がん細胞を攻撃するようにする薬剤。抗PD-1抗体などが含まれ、現在のがん治療に欠かせない薬剤である。
インターフェロン–ガンマ(IFN-γ)
抗腫瘍性サイトカイン。がん抗原特異的細胞傷害性T細胞(キラーT細胞)やナチュラルキラー細胞(NK細胞)などの抗腫瘍免疫細胞から産生され、がん細胞上の受容体を刺激して下流のJAK1/2やIRF1にシグナルを伝達し、細胞死の誘導や免疫原性を増大させる作用を持つ。
■ 論文詳細
論文名: SOX10 regulates melanoma immunogenicity through an IRF4-IRF1 axis.
著者: Satoru Yokoyama, Atsushi Takahashi, Ryota Kikuchi, Soshi Nishibu, Jennifer Lo, Miroslav Hejna, Wooyoung M. Moon, Shinichiro Kato, Yue Zhou, F. Stephen Hodi, Jun S. Song, Hiroaki Sakurai, David E. Fisher, Yoshihiro Hayakawa
2021.11.04 研究成果









