ジオスゲニンはアルツハイマー病マウスの脳で萎縮した軸索を 再び伸ばしつなげて記憶障害を回復させる
■ポイント
①アルツハイマー病※1モデルマウスの脳の中では、軸索※2が萎縮し、神経間のつながりが途切れてしまっていることが分かった。
②しかしジオスゲニン※3を飲むと、軸索は元の場所へ伸長しつながり、それによって記憶が改善した。
③ジオスゲニンによって軸索が正しく伸びる際の分子機序※4を初めて明らかにした。
■ 概要
本研究所・神経機能学領域の楊熙蒙助教と東田千尋教授は、かねてより、ヤマノイモ、ナガイモ(漢方では生薬の“サンヤク”として使われている)の成分として知られているジオスゲニンの認知症への効果を研究してきました。
アルツハイマー病など認知症を根本的に治療するには“破綻した神経回路を再形成する”ことが非常に重要ですが、成体の脳においては、一度変性した(萎縮した)神経細胞の突起の修復は困難であり、特に軸索は、遠く離れた場所まで正しく再伸長して機能しなければならず、いったんダメージを受けた軸索を回復させることは、治療戦略としては実現不可能ではないかとされ、ほとんど着目されてきませんでした。
しかし今回の研究によって、
・アルツハイマー病モデルマウスの脳の中では、軸索が萎縮し、神経間のつながりが途切れてしまっているが、ジオスゲニンを飲むと、軸索は元の場所へ伸長しつながり、それによって記憶が改善すること
・ジオスゲニンによって軸索が正しく伸びる分子機序として、軸索上のSPARC※5が細胞外のI型コラーゲン※6と相互作用すること
を初めて明らかにしました。本研究成果は、根本的な認知症の治療に向けて画期的な一歩となるものです。
本研究成果は、「Molecular Psychiatry」オンライン版において
2023年4月22日(土)午前9時(日本時間)
(4月22日(土)午前1時(グリニッジ標準時))に掲載されます。
■研究の背景
アルツハイマー病では、発症よりも20-30年も前の無症状期から脳内にアミロイドベータが蓄積し、それに伴って神経回路が変性することで、記憶障害を始めとした認知機能障害が引き起こされます。この原因物質を除去するだけでは既に破綻した神経回路の修復は困難であるため、私たちは、“破綻した神経回路を再形成する”ことが、アルツハイマー病の根本的治療に必須であると考え研究を進めてきました。神経回路の形成には、神経細胞の突起である「軸索」が投射先の神経細胞の樹状突起にシナプス結合する必要があります。特に軸索は遠く離れた部位に向かっても長く伸長し、そこの神経細胞に情報を伝えなければなりません。しかし成体の脳においては、一度変性した(萎縮した)軸索は再伸長できないと考えられてきたため、治療戦略としては実現不可能として、ほとんど着目されてきませんでした。
一方、私たちは長年の研究によって、ヤマノイモ、ナガイモ(漢方では生薬の“サンヤク”として使われている)の成分として知られているジオスゲニンには、培養した神経細胞での軸索伸展作用、アルツハイマー病モデルマウスの記憶障害を改善させる作用、そして健常人の認知機能を向上させる作用があることを見出してきました。そこで本研究では、ジオスゲニンによる記憶障害改善作用が、軸索の修復によってもたらされることを検証するため、アルツハイマー病モデルマウス脳内で萎縮した軸索を、ジオスゲニンが再び伸長させる証拠と、その機序を明らかにすることを目指しました。
■研究の内容・成果
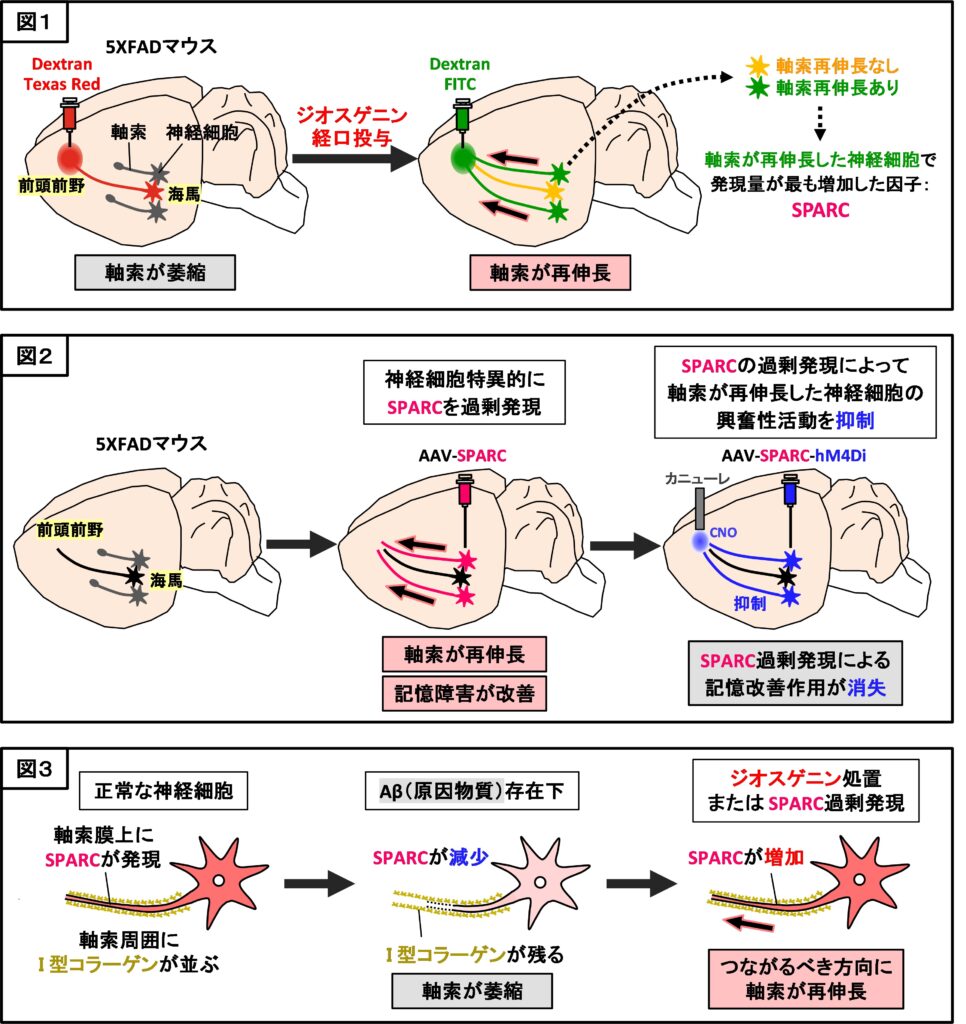
成熟した成体脳では、軸索の再生は困難であると一般的に考えられてきましたが、ジオスゲニンによってそれが起きるかどうかを検討するために、神経細胞の軸索を可視化する手法を用いました。記憶形成に関わることが知られている、海馬から前頭前野に軸索を投射する神経回路に着目しました。野生型マウス(対照群としての正常マウス)及びアルツハイマー病モデルの5XFADマウスの前頭前野に赤色蛍光の逆行性トレーサーDextran Texas Red (3000 MW) を注入後、溶媒またはジオスゲニンを14日間経口投与し、同一部位に緑色蛍光の逆行性トレーサーDextran FITC (3000 MW) を注入し、さらに7日置いた後、脳を観察しました。正常マウスと比較して5XFADマウスでは、海馬神経細胞から前頭前野に投射する軸索が減少していることが示され、さらにジオスゲニンの経口投与により、海馬から前頭前野に向かう軸索が再伸長することが示されました(図1)。
続いて、軸索が再伸長しなかった神経細胞とジオスゲニン投与により軸索が正しく再伸長した神経細胞1個1個を海馬から単離し、マイクロアレイで遺伝子の発現量変化を網羅的に解析しました。その結果、軸索が再伸長した神経細胞中で発現量が増加した因子として、SPARC (Secreted protein acidic rich in cysteine)を同定しました(図1)。
神経細胞特異的にSPARCを過剰発現させるウィルスベクターを5XFADマウスの海馬両側に注入すると、海馬神経細胞中でのSPARCの過剰発現が確認され、かつ、物体認知記憶及び空間認知記憶障害が改善し、海馬から前頭前野に投射する軸索の再伸長も促進されました(図2)。また、SPARCの過剰発現により海馬から前頭前野に軸索を再投射した神経細胞だけを狙ってその興奮性活動を抑制すると、SPARC過剰発現によっていったん示された記憶改善作用が消失しました(図2)。
さらに、軸索再伸長中の軸索では、特に軸索膜上でSPARCが増加すること、軸索に沿うように細胞外I型コラーゲンが並ぶこと、軸索が萎縮してもI型コラーゲンは残ること、SPARCは細胞外I型コラーゲンをたどるように相互作用することで、元々伸びていた方向に再び軸索を伸長させることを明らかにしました(図3)。
以上本研究では、ジオスゲニンが、アルツハイマー病モデルマウス脳内の萎縮した軸索を、遠く離れた投射先へと再伸長させることを見出しました。また、ジオスゲニン投与によって軸索上に増加したSPARCは、軸索の外側に配置するI型コラーゲンと相互作用して軸索を遠くまで正しく再伸長させることを初めて明らかにしました。
■今後の展開
本研究により、ジオスゲニンは、破綻した神経回路の機能を再び活性化させることが示唆されました。現状の治療薬は、認知症の進行を遅らせるにとどまっていますが、ジオスゲニンは軸索を修復することによって、既に発症してしまった記憶障害を回復させました。ジオスゲニンが、アルツハイマー病をはじめとした認知症の根本的治療を可能とすることを、今後は臨床研究によって検証していきます。
【用語解説】
※1 アルツハイマー病
アルツハイマー型認知症のこと。進行性に脳の神経細胞が萎縮し認知機能が低下する。組織学的にはアミロイドベータの沈着(老人班)や神経原線維変化の出現を特徴とする。
※2 軸索
神経細胞から伸長する突起であり、投射先の神経細胞に信号を伝える。
※3 ジオスゲニン
生薬のサンヤク(ヤマノイモやナガイモ)の成分として知られる化合物。ただし実際には、ヤマノイモやナガイモ中にその形ではほとんど存在していない。
※4 分子機序
(軸索が正しく伸びるために)神経細胞の中でどのタンパク質がどのように働いているかという仕組みのこと。
※5 SPARC
secreted protein acidic and rich in cysteineの略。細胞内・外、細胞膜に広く発現し、細胞接着・組織修復作用をもつ糖タンパク質。中枢神経系での発現は、発達期でピークとなり、成熟に伴って減少する。脳損傷後の修復期に、発現が増加することも知られている。
※6 I型コラーゲン
体内に豊富に存在するコラーゲンの1種。I型コラーゲンは線維形成性で、ほとんど全ての結合組織に存在し、脳内にも存在する。
【論文詳細】
論文名:
Diosgenin restores memory function via SPARC-driven axonal growth from the hippocampus to the PFC in Alzheimer’s disease model mice.
(ジオスゲニンはアルツハイマー病モデルマウスにおいて、SPARCが駆動する海馬から前頭前野への軸索投射によって記憶機能を回復させる)
著者:
Ximeng Yang, Chihiro Tohda (楊 熙蒙、東田 千尋)
所属:富山大学 和漢医薬学総合研究所 神経機能学領域
掲載誌:
Molecular Psychiatry 2023年4月22日オンライン公開
2023.04.24 研究成果









