既存の抗がん剤とは異なる作用機序に基づく新たな膵臓がん治療薬候補化合物の創製に成功
■概要
膵臓がんは他のがん種と比較して5年生存率が最も低いため、新たな治療薬の開発が強く望まれています。
富山大学和漢医薬学総合研究所 Suresh Awale 准教授、学術研究部工学系 豊岡尚樹 教授、岡田卓哉 助教、学術研究部医学系 藤井努 教授、奥村知之 講師および名古屋大学大学院医学系研究科 神田光郎 講師らの国内共同研究グループは、既存の抗がん剤とは異なる作用機序に基づく画期的な膵臓がん治療薬 候補化合物の創製に成功しました。これは膵臓がん化学療法の選択肢が広がり得る極めて大きなインパクトを与える結果です。
本研究成果は、2023 年 5 月 31 日(水)に医薬品化学分野の権威ある米国化学会誌「Journal of Medicinal Chemistry」にオンライン掲載されました。
■研究の背景
膵臓がんは他のがん種と比較して5年生存率が最も低いことから、最難治性固形がんとして位置付けられています。膵臓は身体の深部に位置するため、一般的に膵臓にできる腫瘍は血管が少ないことが知られています。そのため膵臓がん細胞には酸素や栄養の供給が制限された「がん微小環境※1」においても生き続けられる独特の生存機構が備わっていますが、既存の抗がん剤であるゲムシタビンやパクリタキセルは急速に増殖するがん細胞を標的にしていることから上記がん細胞に効果を示しません。また重篤な副作用が問題となっていることからも、「がん微小環境」下で有効に作用する新たな作用機序に基づく治療薬の開発が強く望まれています。したがって、当研究グループはがん微小環境下におけるがん細胞に対して選択的かつ強力に毒性を示す化合物が新たな膵臓がん治療薬へと繋がり得ると期待し、研究を展開してきました。
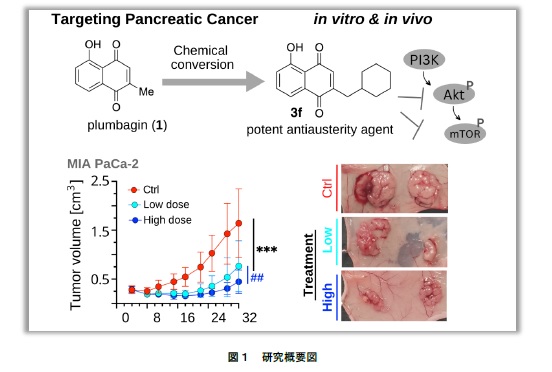
■研究の内容・成果
このような中、イソマツ科植物 Plumbago auriculata(ルリマツリ)※2の成分であるプルンバギン※3ががん微小環境下における膵臓がん細胞に対して選択的に細胞毒性を示すことを明らかにしました。そこでプルンバギンの化学構造を基に新規化合物を合成した結果、プルンバギンよりも強力かつ選択的な細胞毒性を示す化合物 3f※4の合成に成功しました。作用機序を検討した結果、化合物 3f は Akt/mTOR シグナル伝達経路※5を阻害することで細胞毒性を発揮することが明らかとなりました。また動物実験においても化合物 3f は十分な抗がん活性を示し、容量依存的かつ有意に腫瘍成長を阻害しました。
■今後の展開
以上の研究結果は、新規プルンバギン誘導体 3f が既存の抗がん剤とは異なる作用機序に基づく新たな膵臓がん治療薬として極めて有望であることを示すのみならず、膵臓がん化学療法の選択肢が広がり得る極めて大きなインパクトを与える結果です。さらに本共同研究グループが開発した新規プルンバギン誘導体 3f は多剤併用療法にも新たな可能性を提供できることから、現在の治療で大きな問題となっている抗がん剤抵抗性の克服にも貢献できることが期待されます。
今後は本共同研究グループが開発した化合物 3f の膵臓がん治療薬としての有効性を臨床研究によって検証していきます。

【用語解説】
※1 がん微小環境
がん細胞とその周りの間質細胞に存在するさまざまな細胞から構成されるがん特異的な局所的環境のこと。このような環境では、がん細胞が腫瘍化を促進するような性質に変化した間質細胞とが相互作用することによって、がんの増殖・転移・悪性化・薬剤耐性化に繋がることが知られている。
※2 Plumbago auriculata(ルリマツリ)
世界的に広く熱帯から寒帯まで分布する双子葉植物イソマツ科の属のひとつであり、花弁が美しく、熱帯地方を中心に約 20 種存在する。
※3 プルンバギン
5-ヒドロキシ-2-メチル-1,4-ナフトキノンとも呼ばれ、古くから抗菌剤や抗炎症剤をはじめとした薬理学的利用が期待されていた化合物。
※4 化合物 3f
本研究においてプルンバギンの構造を基に合成展開した化合物の中で、がん微小環境下において最も良好な抗がん活性を示した化合物。
※5 Akt/mTOR シグナル伝達経路
細胞周期を制御する重要な細胞内シグナル伝達経路であり、細胞の静止期、増殖、がん、長寿などに関連している。
English Version
2023.06.05 研究成果









